El enlace iónico se da entre átomos de electronegatividad muy
diferente, en cambio, el enlace covalente se da entre elementos de
alta electronegatividad muy parecida.
En vez de
una cesión de electrones, ( como
tiene lugar en el enlace iónico), se produce una
compartición de pares de e‑, que
se
concentran entre los núcleos enlazándolos. El número de pares de
electrones compartidos será el necesario para que los dos átomos
adquieran configuración electrónica de gas noble. A diferencia del
enlace iónico, el enlace covalente es
direccional y más fuerte; y su formación también comporta una
liberación de energía. En la siguiente dirección puedes encontrar una
simulación del enlace covalente en la molécula de Hidrógeno:
como
tiene lugar en el enlace iónico), se produce una
compartición de pares de e‑, que
se
concentran entre los núcleos enlazándolos. El número de pares de
electrones compartidos será el necesario para que los dos átomos
adquieran configuración electrónica de gas noble. A diferencia del
enlace iónico, el enlace covalente es
direccional y más fuerte; y su formación también comporta una
liberación de energía. En la siguiente dirección puedes encontrar una
simulación del enlace covalente en la molécula de Hidrógeno:
 como
tiene lugar en el enlace iónico), se produce una
compartición de pares de e‑, que
se
concentran entre los núcleos enlazándolos. El número de pares de
electrones compartidos será el necesario para que los dos átomos
adquieran configuración electrónica de gas noble. A diferencia del
enlace iónico, el enlace covalente es
direccional y más fuerte; y su formación también comporta una
liberación de energía. En la siguiente dirección puedes encontrar una
simulación del enlace covalente en la molécula de Hidrógeno:
como
tiene lugar en el enlace iónico), se produce una
compartición de pares de e‑, que
se
concentran entre los núcleos enlazándolos. El número de pares de
electrones compartidos será el necesario para que los dos átomos
adquieran configuración electrónica de gas noble. A diferencia del
enlace iónico, el enlace covalente es
direccional y más fuerte; y su formación también comporta una
liberación de energía. En la siguiente dirección puedes encontrar una
simulación del enlace covalente en la molécula de Hidrógeno:
Algunos ejemplos de este tipo de enlaces son:
‑ el cloruro de hidrógeno:

al
ser el átomo de cloro más electronegativo, atraerá más hacia él los
electrones del enlace y se quedará cargado con una fracción de carga
negativa.
‑ el agua:
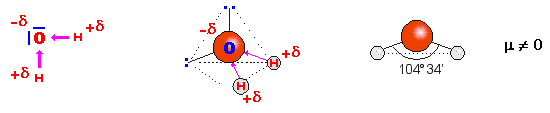
la diferencia de electronegatividad entre el O y el H explica su
elevada polaridad y ésto hace que pueda utilizar como disolvente.
‑ el amoniaco:
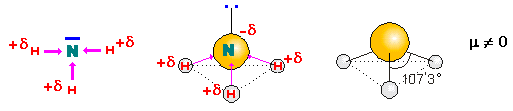
la molécula de amoniaco posee tres enlaces simples polares.
-el ozono: En el enlace simple, es
el átomo central el que aporta los dos electrones del enlace:
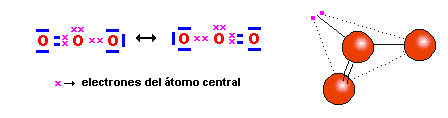
‑ el ion amonio; por ejemplo en
el cloruro amónico (NH4Cl): es un compuesto iónico, forma
redes tridimensionales, (NH4+ Cl‑),
donde el catión no es un átomo sino una especie poliatómica en la que
sus átomos están unidos por enlaces covalentes, uno de ellos
coordinado o dativo:

uno de los H ha perdido un e‑ y forma con el par de
electrones que tiene el N, un enlace covalente coordinado.
No hay comentarios:
Publicar un comentario